寿の生物学:老化とは「時間」ではなく「情報の劣化」✉️38✉️
日本だけでなく、世界の多くの国々、いまや米国でさえ高齢化社会の現実に直面しています。
一方、人類は、今、「老いる」という現象を、分子レベルで解きあかしつつあります。長寿を極めたホッキョククジラやベニクラゲ、あるいは老化の鍵を握る「ゾンビ細胞(老化細胞)」など、時間と生命の関係を教えてくれています。
今回は、合成生物学の対象として注目され、医療・製薬・美容・データ産業を巻き込む「老化」研究を取り上げます。
近年は「長寿」をめぐる研究やスタートアップ投資が急速に拡大し、世界中の科学者や企業が「老化を治療可能な現象」として再定義し始めています。老化研究の最前線を「タイプ別」に整理しながら、そこに見えてきた新しい生命観、課題、そして社会的インパクトを探ります。
老化とは「時間」ではなく「情報の劣化」である
老化は、長らく「不可避の自然現象」として受け止められてきました。しかしここ十年ほどで、その理解は根底から書き換えられつつあります。老化は時間の経過ではなく、「分子情報の劣化」であり、制御可能なプロセスである――そんな科学的な視点が、現実味を帯びてきているのです。
近年の研究は、老化を「細胞の時計」ではなく「生物情報のエラー蓄積」として捉える方向に進んでいます。DNAの損傷やエピジェネティックな変化(遺伝子のオン・オフを司る化学修飾)は、細胞が設計図を正確に読み取れなくなることを意味します。
ハーバード大学のDavid Sinclair教授が提唱した「情報理論的老化仮説(Information Theory of Aging)」は、まさにこの観点から老化を再定義しました。老化とは時間の流れではなく、情報のノイズが増大し、細胞が自らのアイデンティティを見失っていく過程だというのです。実際、マウスの神経細胞に人工的なDNA損傷を導入すると、若い個体でも記憶力や行動パターンが「老化型」に変化します。老化は、時間ではなく情報の破損として再現できる――その実験的証拠が積み重ねられつつあります。
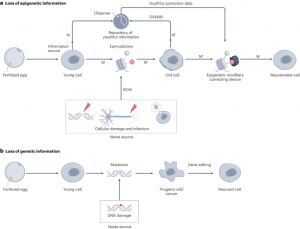
情報の保存と検索は、あらゆる生命にとって不可欠である。生物学において、情報は主に二つの異なる様式で保存されている。第一は、核酸から構成されるゲノムであり、生命の基本設計図として機能する。第二は、DNAおよびヒストンタンパク質への化学的修飾から成るエピゲノムであり、遺伝子発現のパターンを制御し、細胞に固有の性質と機能を付与している。遺伝情報が安定したデジタル的性質をもつのに対し、エピゲノム情報はデジタルとアナログが混在する形式で保存され、環境シグナルや細胞損傷によって変化を受けやすい特徴をもつ。「老化の情報理論(Information Theory of Aging, ITOA)」は、老化とは若年期に特有のエピゲノム情報が徐々に失われていく過程であるとする仮説である。そして、エピゲノムの再プログラミングによってこの喪失した情報を回復することで、損傷した組織や老化した組織の機能を改善し、加齢の逆転を引き起こすことが可能であると主張する。
この観点から、いま世界中の研究者が注目しているのが、「老化しない、あるいは極端に遅い」生物たちです。彼らの体内では、情報エラーを抑える高度な修復メカニズムが働いている可能性があるのです。
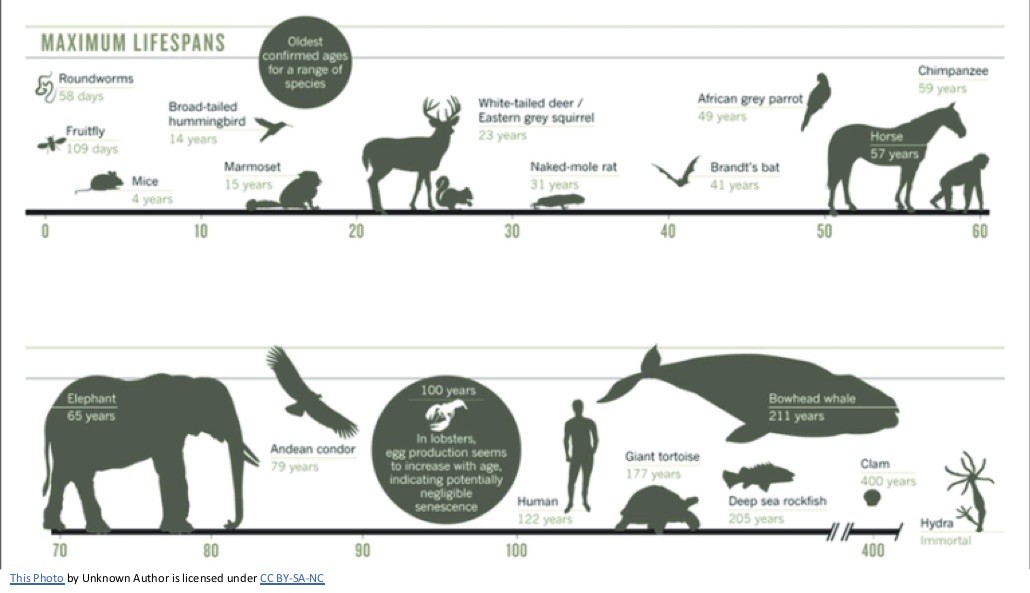
200年を生きるホッキョククジラ──「修復型長寿戦略」
北極の氷海を泳ぐホッキョククジラは、地球上で最も長生きする哺乳類です。その寿命は200年以上に及び、捕鯨銛が体内から見つかることさえあります。通常、体が大きいほど、細胞の数も多いので、がんリスクは上がるはずですが、クジラやゾウでは逆に発症率が低い。この逆説は「ピトーのパラドックス(Peto’s paradox)」と呼ばれ、長らく進化生物学の謎でした。
ロチェスター大学の研究によれば、ホッキョククジラの細胞はDNA損傷修復能力が非常に高く、放射線や薬剤による変異率がヒトよりも著しく低いことが判明しました。その鍵を握るのが、CIRBP(Cold-Inducible RNA-Binding Protein)という低温応答タンパク質です。北極の海水温はマイナス1〜2度。この環境で細胞を守るため、CIRBPがDNA修復装置を安定化させ、ゲノムを凍結保存のように守っているのです。
ヒト細胞にCIRBPを導入すると、DNA損傷後の回復が早まり、がん化リスクが減少しました。ショウジョウバエでは寿命延長効果も確認されました。つまり、極限環境で進化した「耐寒遺伝子」が、老化そのものを遅らせる分子戦略を内包しているのです。
地下に生きる「不老ネズミ」──4つのアミノ酸が老化を止めた
もう一つの長寿生物、ハダカデバネズミは、アフリカの地中で40年以上を生き、がんにもほとんどならず、繁殖能力も衰えません。上海・同済大学の研究によれば、その秘密は「cGAS」というDNA感知タンパク質にありました。
通常、cGASはDNA損傷を検出して炎症反応を誘発しますが、炎症は老化を促進する要因でもあります。ところが、ハダカデバネズミのcGASは、アミノ酸配列中のわずか4つのアミノ酸の違いによって、炎症を抑えつつDNA修復を促進する性質へと進化していたのです。このハダカデバネズミ型cGASをマウスやヒト細胞に導入すると、老化マーカーが低下し、DNA修復が加速。進化の偶然が、老化を抑制する分子スイッチをONさせることが可能になります。
テロメアの摩耗とゲノム安定性
テロメアの摩耗は老化を象徴する現象の一つです。テロメアは染色体の末端に位置する反復DNA配列であり、ゲノムの安定性を守る「保護キャップ」として機能します。細胞が分裂を繰り返すたびにテロメアは徐々に短くなり、一定の長さを下回ると染色体末端がDNA損傷と誤認され、細胞は分裂を停止します。これがいわゆる複製老化のメカニズムです。
テロメラーゼと呼ばれる酵素は、この短縮に対抗してテロメアに新たなDNA配列を付け加える働きを持ちます。多くの真核生物では、このテロメラーゼ活性がテロメアの維持と細胞生存に不可欠です。さらに、テロメアはクロマチンとして強くコンパクト化されており、DNA損傷応答機構から末端を守る堅牢な構造を形成しています。
しかし、加齢に伴いDNA損傷がゲノム全体に蓄積していくと、テロメアも例外ではなくなります。テロメア機能不全誘発性病巣やテロメア関連病巣と呼ばれる損傷が発生すると、染色体末端の保護が崩壊し、ゲノムの不安定化が進行します。その結果、テロメア生物学的障害(telomere biology disorders)やテロメア症候群と呼ばれる疾患群を引き起こすことが知られています。
近年では、ノンコーディングRNA(ncRNA)がテロメア長維持の重要な調節因子として注目を集めています。これらのRNA分子は、テロメア構造の安定化やテロメラーゼの局在制御に関与し、老化や老化関連疾患の進行を抑制する新たな分子メカニズムとして研究が進められています。
ゾンビ細胞とセノリティクス──「壊れた細胞」をどうするか
一方、ヒトの老化を止める試みとして注目されているのが、「セノリティクス(Senolytics)」と呼ばれる老化細胞を除去するアプローチです。
老化細胞はもはや分裂せず、死なずに残って炎症性物質を放出し続けます。これが周囲の組織を蝕むことから、「ゾンビ細胞」と呼ばれます。2010年代にメイヨークリニックの研究で、ダサチニブ(白血病治療薬)とケルセチン(ポリフェノールの一種)の併用によって老化マウスの寿命と機能が回復することが示されました。以降、この除去戦略は糖尿病、アルツハイマー病、骨粗鬆症など加齢性疾患への応用が検討されています。
しかし、セノリティクスは「壊れた細胞を捨てる」戦略です。ホッキョククジラやデバネズミのような「修復して生かす」アプローチとは対照的です。老化研究はいま、「除去」か「修復」かという二大潮流に分かれているのです。
NAD⁺とNMN──老化をエネルギーから制御する
一方で、老化を「進行を止める」ではなく「若返らせる」方向で研究する流れもあります。とくに注目を集めているのが、NAD⁺(ニコチンアミドアデニンジヌクレオチド)の研究です。NAD⁺は、すべての細胞でエネルギー代謝を担う補因子で、加齢とともに体内量が減少します。NAD⁺が不足すると、DNA修復を司るサーチュイン遺伝子の活性が落ち、細胞が老化しやすくなります。このNAD⁺を再補充する前駆体として注目を浴びたのが、ニコチンアミド・モノヌクレオチド(NMN)やニコチンアミド・リボシド(NR)です。
2016年にセントルイス・ワシントン大学の今井真一郎博士らが発表した研究では、NMNを投与した老齢マウスが、血糖調節や運動能力において改善を示しました。さらに、シンクレア研究室では、NAD⁺濃度を回復させることでエピジェネティックな時計(DNAメチル化パターン)が若返ることを確認。細胞の時間を部分的に巻き戻すことが可能であることを示したのです。
ただし、NMNのヒトへの効果については、2024年のメタ分析では「プラシーボとの有意差なし」など依然として議論があります。2023年にはFDA(米国食品医薬品局)がNMNを「医薬品候補」として規制しましたが、2025年9月に方針転換し、サプリメントとして合法と再認定しています。ただし、不確実性が残る条件付きの緩和です。
つまり、NMNが「若返り薬」として誇張されていることには注意するべきです。現時点では寿命そのものを延ばすエビデンスはまだ限定的です。
若返り因子GDF11──血液が示す“逆転の鍵”
もう一つの若返り因子が、GDF11(Growth Differentiation Factor 11)という分子をめぐる研究です。GDF11は成長分化因子の一種で、かつては「若返りホルモン」として注目を浴びました。
2014年、ハーバード大学の研究チームは、若いマウスと老いたマウスの血液を共有する「パラバイオシス実験」で、老マウスの筋肉や脳機能が回復する現象を報告しました。その際、若い血液中で増えていた因子の一つがGDF11だったのです。
GDF11は加齢とともに減少し、これを補うと老化した血管や心筋が再生するという結果も示されました。さらに、脳内の神経幹細胞の増殖を促進し、認知機能を改善するという報告もあります。
一方で、その後の研究では「効果は限定的」「高濃度では逆に筋力が低下する」といった反論もあり、論争が続いています。それでも、血液中の情報分子が老化速度を左右するというアイデアは、老化研究のパラダイムを一変させました。GDF11を含む「血液リプログラミング」の研究は、若返り医療の新たなフロンティアになりつつあります。
老化のリプログラミング──「時間を巻き戻す」試み
より大胆な試みが、iPS細胞技術を応用した「部分的リプログラミング」です。山中伸弥教授が発見した4つの因子(Oct4, Sox2, Klf4, c-Myc)を一時的に発現させることで、老化した細胞を完全には初期化せず、若返らせる手法です。
2020年代には、マウスの網膜細胞で加齢による視力低下を回復させることに成功しました。これは老化が可逆的である可能性を示す成果です。現在、Google傘下のCalicoやAltos Labsなどが「老化リプログラミング」の実用化を目指し、莫大な投資を行っています。
修復・除去・代謝──老化をめぐる三つの戦略
こうして整理すると、現代の老化研究はおおよそ三つの方向に分かれます。
修復型(Repair):若返り薬や老化リプログラミング。あるいはDNA損傷を元に戻す。ホッキョククジラやハダカデバネズミの戦略。
除去型(Clearance):ゾンビ細胞を排除する。セノリティクスに代表される。
代謝型(Rejuvenation):エネルギー代謝やNAD⁺経路を活性化する。
これらは競合するのではなく、補完的です。DNA修復を支えるにはNAD⁺が必要であり、老化細胞を除去する過程でも代謝再構築が重要になります。老化は単一のスイッチではなく、多層的なシステムなのです。
科学的挑戦と商業化の壁
こうした背景から、老化を標的にした新たなスタートアップが次々と登場しています。彼らは、分子レベルの新薬開発からAIを活用した寿命予測、さらにはサプリメントを通じた直接消費者向け(DTC)戦略まで、さまざまなアプローチで“老いの市場”に挑んでいます。
しかし、老化研究の商業化は、他の医療分野とは異なる独特の課題を抱えています。
第一の問題は、「モデル生物への過度な依存」です。線虫やマウスで寿命を延ばすことに成功した遺伝子操作や薬剤が、ヒトにも同様に作用するとは限りません。ヒトの老化は環境・代謝・免疫など多層的な要因が絡み合っており、その単純化は非常に難しいです。
第二に、「老化の本質に関する生物学的な合意」がまだ得られていません。DNA損傷説、ミトコンドリア仮説、炎症仮説など、さまざまな理論が提唱されていますが、どれも老化現象全体を説明する決定的なモデルとは言えません。 そのため、企業がどの分子経路を標的にすべきかを見極めるのは容易ではないのです。
第三として、「臨床試験の設計そのものが極めて難しい」という現実もあります。老化を「疾患」として定義できない以上、医薬品としての承認を得るには「特定の疾患(糖尿病や認知症など)」に対する効果を証明しなければなりません。しかも老化関連の変化を観察するには、数年単位、さらに長い期間の追跡が必要です。適切なバイオマーカーが存在しないことも、検証を遅らせる大きな要因となっています。
老化は病か、それとも進化か?
WHOの国際疾病分類(ICD-11)では老化は疾病としてはいません。しかし、老化を「病気」として治療対象にする動きは加速しています。FDAも老化を標的とする臨床試験を承認し、セノリティクスやNMN研究が進んでいます。
世界の投資家たちは「ヘルススパン(健康寿命)」を延ばすベンチャーに資金を投じていますし、DeSci(分散型科学)のDAO(分散型自律組織)などでも老化研究は最も効果的な標的になっています。
しかし、哲学的な問いも避けられません。老化は本当に「治すべき」ものなのでしょうか。
ホッキョククジラのCIRBPは寒冷地への適応の結果であり、ハダカデバネズミのcGASは低酸素環境への適応の副産物という考えもできます。つまり、長寿は「目的」ではなく「環境適応の結果」なのかもしれません。ヒトが老化を制御することは、進化の偶然を意図的に再設計する試みでもあります。